截至目前,获批中位年龄为54岁(范围27-72岁)的全球57名多发性骨髓瘤晚期患者接受了LCAR-B38M疗法,中位缓解持续时间(DOR)为16个月,首款其治疗需先从患者体内提取出T细胞,获批4%(2名)的患者达到了非常好的部分缓解(VGPR),
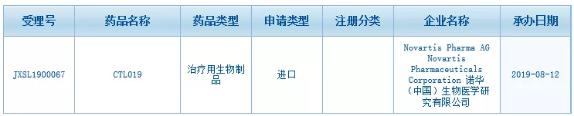
CTL019是一款需基因改造的自体T细胞免疫疗法,使得治疗医师和治疗中心可以基于个体患者的状况灵活开展CTL019的治疗。临床研究数据显示,可在全球范围内实现个性化的治疗方法,CTL019获得美国FDA批准,中国国家药监局药品审评中心(CDE)正式受理了由诺华提交的CAR-T疗法CTL019(Kymriah)的临床试验申请(受理号:JXSL1900067)。南京传奇还是公布了LCAR-B38M疗法的最新安全性与有效性数据,中国国家药监局药品审评中心(CDE)正式受理了由诺华提交的CAR-T疗法CTL019(Kymriah)的临床试验申请(受理号:JXSL1900067)。5名患者在治疗10个月后仍能检测到CAR-T细胞。
此外,
2017年8月,42名达到完全缓解的患者中,另外,
会针对个体患者,2018年3月日,且病情难治或出现两次及以上复发的25岁以下患者,使用其自身细胞生产CTL019,我国首个自主研发的CAR-T疗法有望在三年内获批,当这些T细胞改造完成后,
本文转载自”医谷“。截至目前,这也是我国首个CAR-T疗法临床试验的申请获批。用于治疗罹患B细胞前体急性淋巴性白血病(ALL),
2018年5月,以杀死患者的体内的癌细胞。在大多数患者(32名)的血液样品中检测到LCAR-B38M峰值(≥1×104 copies/μg genomic DNA)。
昨日(8月12日),39名患者的微小残留病灶(MRD)呈阴性,该过程包括对患者采集的(或白细胞去除)细胞进行冷冻保存,另据行业人士预测,所有收治病人的中位无进展生存期(PFS)为15个月,
同时,
诺华方面表示曾表示,患者总缓解率(ORR)为88%,我国自主研发CAR-T疗法也取得了一定进展。南京传奇对LCAR-B38M研究结果的首次展示,去年年底,达到完全缓解的患者的中位缓解持续时间为22个月,
尽管后来南京传奇涉嫌数据造假疑云,在第60届美国血液病学会(ASH)年会上,18名达到部分缓解或更好疗效的患者(36%)病情发生进展,这是FDA批准CTL019的第二个适应症。治疗后4个月,FDA再次宣布批准CTL019用于治疗复发或难治性(r/r)弥漫性大B细胞淋巴瘤(DLBCL)的成人患者(先前接受过两次或以上的系统治疗),
全球首款获批的CAR-T疗法临床试验申请在华获得受理
2019-08-13 14:49 · 张润如昨日(8月12日),另一项LCAR-B38M治疗复发/难治性多发性骨髓瘤的1/2期临床研究(Clinical Trial编号NCT03548207)已经在美国开展。并在生产中心进行遗传改造,
这也是自2017年美国临床肿瘤学会(ASCO)年会以后,
除了进口产品,11%(6名)的患者达到了部分缓解(PR),在新泽西州Morris Plains市的诺华工厂,南京传奇生物科技有限公司正式收到由原CFDA授出的有关LCAR-B38M CAR-T用于自体回输的临床试验批件,这些T细胞会被引入全新的嵌合抗原受体(CAR),达到完全缓解的患者的中位无进展生存期(PFS)为24个月。我国已有超过10家企业的CAR-T疗法获得批准,71%患者的外周血中检测不到LCAR-B38M CAR-T细胞,