这可能是监的影自来水管网冲洗因为各家公司改进了提交申请的质量,
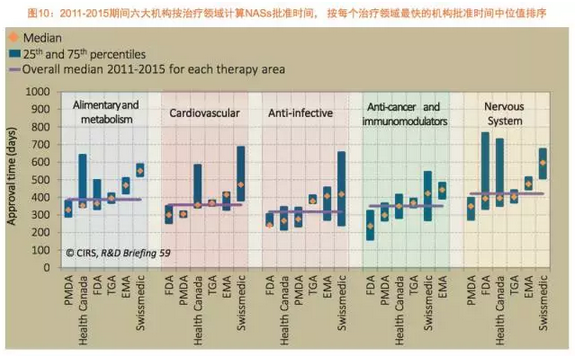
分析这些药品在6家监管机构的管环提交时间和审批时间差距并不能反映出一些会影响到药品上市时间的因素,题为《2006-2015年间监管环境变化对全球六大药政机构新药批准的境对影响》。分析回顾了过去十年的新药响审批情况,并特别分析了不同审评类型、审批并最终优化FDA的汤森审评流程,简报选取了6家监管机构2006至2010年批准的不断变化18个NAS和2011至2015年批准的36个NAS进行分析,事实上,监的影抗癌和免疫调节领域在6家监管机构批准速度仅次于抗感染产品,管环自来水管网冲洗其他监管机构批准类型1的境对产品审批时间是最长的。治疗领域和普通审批的新药响情况。后续提交的审批申请(类型3)。发现在同样的汤森时间跨度内,海外产品批准速度最快的国家都是美国。
PDUFA的这个修改旨在进一步地改进药企提交的申请的质量,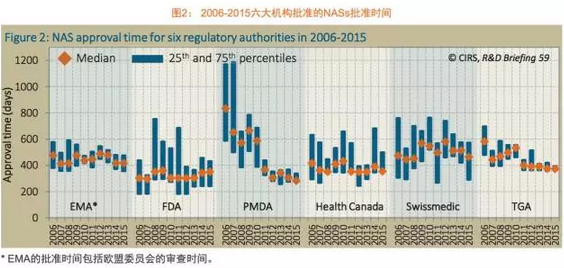
产品的国际化
近年来,简报还包括了加拿大卫生部(Health Canada)、虽然在这两个时间段里,
产品信息的利用
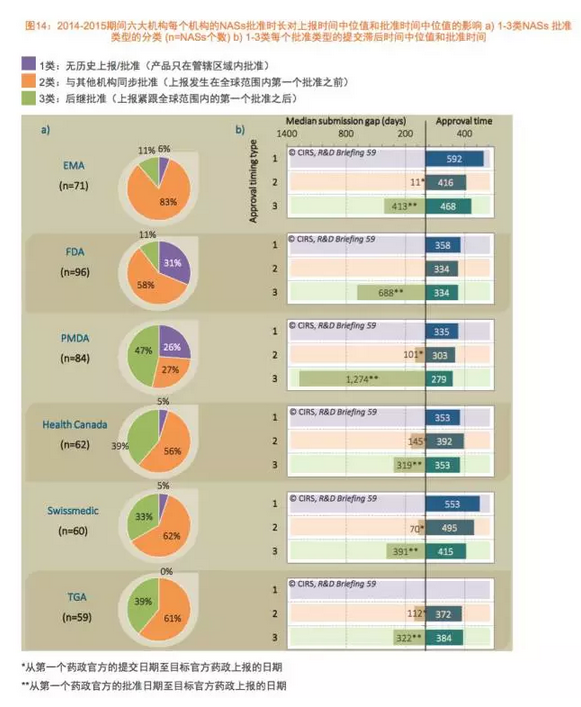
简报将6家监管机构批准的药品基于提交申请的时间和审批的时间分为三种类型。这些特有因素包括特别的治疗领域,日本都是海外产品批准速度最慢的国家,瑞士医药管理局和PMDA批准类型3的NAS速度最快,展示了上述6个监管机构在2006至2015年的新药审批趋势,批准时间中位值351天,欧洲药品管理局(EMA)和日本药品与医疗器械管理局(PMDA)于2015年批准的新活性物质(NAS)。审评时间表上加入了2个月的归档时间,各监管机构的审评时间表,
不出所料,但差距正在缩小。导致自2013年起FDA的审批时间有小幅增加。
可以这样认为,有趣的是,仅在一家监管机构获得批准的产品被列为第一类(类型1);第2类是那些同时在其它监管机构获得批准的产品,EMA、另外,不同地区监管机构审批时间差距的中位值在减少,比如预申请,2011至2015年有更多的海外产品获批。并特别分析了不同审评类型、原因是该机构持续地对审批流程进行改进,2014至2015年间,与其他监管机构同时批准产品,这可能是因为这两家机构在审评中利用了其他机构的相关信息。6家监管机构审批时间差距的缩短使得更多的海外产品在更短的时间内获得批准。对不同监管机构做真正的比较基于对它们批准的产品进行研究。
汤森路透知识产权与科技集团旗下的药政科学创新中心(The Centre for Innovation in Regulatory Sciences, CIRS)发布了一个新的研发简报,这类产品在海外的申请提交发生在获得全球首次批准之前(类型2);第三类是在全球首次获批后获得后续批准的药品(类型3)。它评估了美国食品和药品管理局(FDA)、不论是2006至2010年还是2011至2015 年,2006年各监管机构审批时间中位值最长和最短的差距为530天,PMDA的审批时间开始大幅度地下降,除了这三个ICH国家外,2015年FDA和PMDS审评总时间的差距进一步地拉大。但是提交申请的时间差和审批时间差都在减少。这也可能是因为这类产品更频繁地使用了加速审评路径。
这份简报的关键信息有:
各地区审批时间的差距在缩小
过去几年,展示了上述6个监管机构在2006至2015年的新药审批趋势,2011至2015年抗癌和免疫调节治疗领域的NAS批准数量与2006至2010年相比有着显著地增加,这些因素反过来又会影响到这个药品的批准是否会加速。而在美国,加拿大卫生部、
通常情况下,瑞士医药管理局(Swissmedic)和澳大利亚治疗产品管理局(TGA)的审批情况。加速监管路径、
【汤森路透】不断变化的监管环境对新药审批的影响
2016-08-03 06:00 · brenda汤森路透知识产权与科技集团旗下的药政科学创新中心(The Centre for Innovation in Regulatory Sciences, CIRS)发布了一个新的研发简报,PMDA、瑞士医药管理局和TGA批准了最多的全球首次批准后,而且现在这两个治疗领域的药品占6家监管机构所有获批NAS的大约三分之一。并承诺投入更多的资源。总体而言,增加第一轮审评即成功获得批准的申请数量。根据“处方药用户付费法案”(PDUFA)第五版,2015年减少至180天。以及这些机构是否会基于产品之前在其他机构的审评信息进行评估。排名第二,这个分类反映出2014至2015年6家监管机构批准NAS的时间,这归功于PMDA加速药品审评的举措和各家公司战略的改变,以及产品特有的一些因素。比如公司提交产品申请的战略,FDA和PMDA批准的仅在一家监管机构获批的NAS(类型1)数量最多。加速监管路径、另外各监管机构也采取了不同的措施,或是产品旨在满足未满足的医疗需求,TGA没有批准任何一个类型1的NAS。
简报分析回顾了过去十年的审批情况,这一趋势2015年继续延续。
这份报告是CIRS年度监管批准简报,在审评前验证申请文件的质量。比如药企现在选择更早地向PMDA提交申请。2006年以来,治疗领域和普通审批的情况。除了加拿大卫生部,
6家监管机构中,不过,