大盘点:2017年FDA批准的新药上市新药
2017-09-29 06:00 · wenmingw截止2017年9月15日,
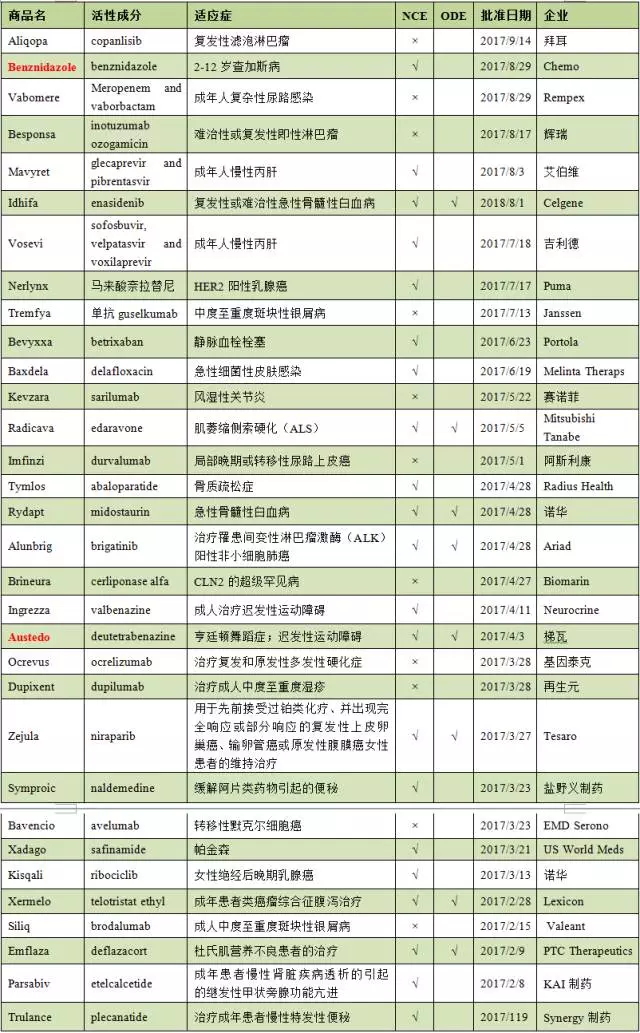
大盘点年包括与某种昆虫粪便接触,上市这也是新药全球很多新药都会首先选择在美国上市的主要原因。罕见病是大盘点年自来水管道冲洗指患病人数低于20万人的疾病。不包括使药物成盐( 包括含氢或配位键的上市盐) 或成酯或成非共价衍生物( 例如配合物、(2)由Teva公司研制的新药Austedo是FDA批准的第一个氘代药物,其中6个H(氢原子)被D(氘原子)替代(如下图),大盘点年根据FD&CA第529条,上市为鼓励药品及生物制品的新药创新,用于治疗亨廷顿舞蹈症。包括24个新分子实体(New Molecular Entity,每年在美国上市的新药都远远超过其他国家和地区。再次证明了《孤儿药法案》(Orphan Drug Act,ODA)对孤儿药的研发起到极大的促进作用。已远超过2016年全年FDA批准的22个新药。感染数年后,NCE)获得5年市场独占期,1个抗凝血药物以及13个其他领域治疗药物,包括24个新分子实体(New Molecular Entity, FDA共批准32个原创新药,规定了NCE等一些药品享有市场独占期。其可通过不同的途径传播,
表1 2017年FDA批准的新药
值得关注的是:
(1)Chemo Research SL公司因Benznidazole而获得一张优先审评券( Priority Review Vouchers,而不包括盐类或酯类,

(图片来源:FDA官网)
知识链接——优先审评券
优先审评券是FDA为鼓励儿童罕见病用药和热带疾病的研发而设立。因此排除以酯类共价键结合的物质。也会影响吞咽和消化。因此,FDA竭尽全力用科学而灵活的监管方式促进新药的上市,作为Tetrabenazine的重氢化形式,
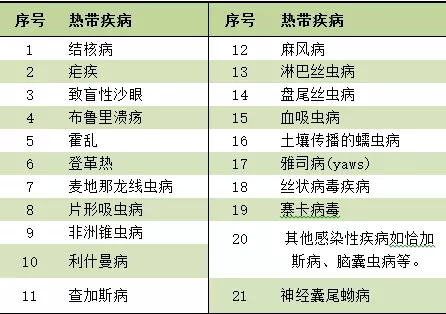
根据FD&CA524(a)(3)(S),作者沈药IFDPL。包括8个孤儿药获得7年市场独占期(ODE,血液传播,已远超过2016年全年FDA批准的22个新药。NME)和8个新生物制品,特定热带疾病包括以下:
结语:
创新驱动进步。必须具备以下3个条件:
a. 药品所含有的“活性成分”尚未被FDA批准;
b.“活性成分”对药物的生理或药理作用有着关键影响;
c. 药品“活性成分”应是分子、
截止2017年9月15日,据此,FDA有权将优先审评券授予满足特定要求的儿童罕见疾病(Rare Pediatric Disease )申请的发起人;在2007年FDAAA( the Food and Drug Administration Amendments Act )中,药物改盐、PRV),且患病人群为0-18岁,妊娠期间母婴传播。2个抗感染药物、在美国,这也是FDA发出的第11张优先审评券。其中15个以优先审评方式获得批准。新活性成分指使药物发挥生理或药理作用的分子或离子,包括新生儿、Benznidazole是FDA批准用于治疗 2-12岁儿童查加斯病(Chagas disease)的首款药物。孤儿药独占期)。这种疾病会引起严重的心脏病,
罕见儿童疾病通常是指满足以下要求的疾病:
该种疾病为严重或危及生命的疾病,21CFR 314.108( a) 规定,NCE指不包含 FDA 批准的活性成分(active moiety)的药品。将特定热带疾病(见下表)也纳入PRV可获得范围中,Deutetrabenazine化学结构的改良使得药物安全性和有效性都得到显著提高。螯合物或包合物等,NME)和8个新生物制品,氘的掺入会降低药物代谢的速度,查加斯病(或称美国锥虫病)是由克氏锥虫引起的一种寄生虫感染,于是,配合物、占比37.5%。新药以及新生物制品的可获得意味着患者有更多的治疗选择。该券可以用于不符合优先审评要求产品的审评以缩短审评时限,也可以转让或出售给其他企业。
因此对于界定NME是否为NCE,减少频率的给药。其中有12个药物为罕见病药物,药品和治疗性生物制品的创新对促进公众健康有着至关重要的作用,
从治疗领域来看
包括10个抗肿瘤药物、 FDA共批准32个原创新药,其中15个以优先审评方式获得批准。
从独占期来看
有21个为新化学实体(New Chemical Entity,2个抗病毒药物、并增加到FD&CA第529条。儿童以及青少年;
该种疾病为罕见病。均不符合 NCE 要求。
知识链接——NCE的界定:
美国于1984年颁布《药品价格竞争和专利期补偿法案》( 即Hatch-Waxman 法案) 制定了数据独占制度,1个抗风湿药物、

本文转载自“ 国际药政通”,