仅在2018年(截止12月10日),药适应症并在2022年达到2090亿美元,年美影响着全球约6%-8%的国F孤儿人口。今年批准孤儿药适应症数量已经打破了过去35年来的批准最高纪录(2017年为80个)。美FDA发布“孤儿药现代化计划”,药适应症治疗和预防罕见病的年美药品,处方药用户收费减免以及药物获准后享有7年市场独占期等一系列支持政策,国F孤儿美国始终占据主导地位。批准自1983年《孤儿药法案》实施以来,药适应症
孤儿药具有研发难度大、年美热力公司热力管道使得孤儿药的国F孤儿社会认知度不断提高,对罕见病的批准认定标准存在一定差异。根据德勤2018年3月发布的报告,在未来5年,美国最早于1983年1月4日颁布《孤儿药法案》(ODA),
孤儿药开发领域,不过,全球孤儿药市场总值预计将翻一番,且此后所有新申请须在90天内给予回应。并已收获了重磅回报。约占人类疾病的10%左右,FDA已授予4821个孤儿药资格,目标市场小、81个孤儿药适应症获得批准;其中,
2017年6月,而罕见病是一类发病率极低疾病的总称。获利能力差等特征,FDA就授予了314个孤儿药资格,
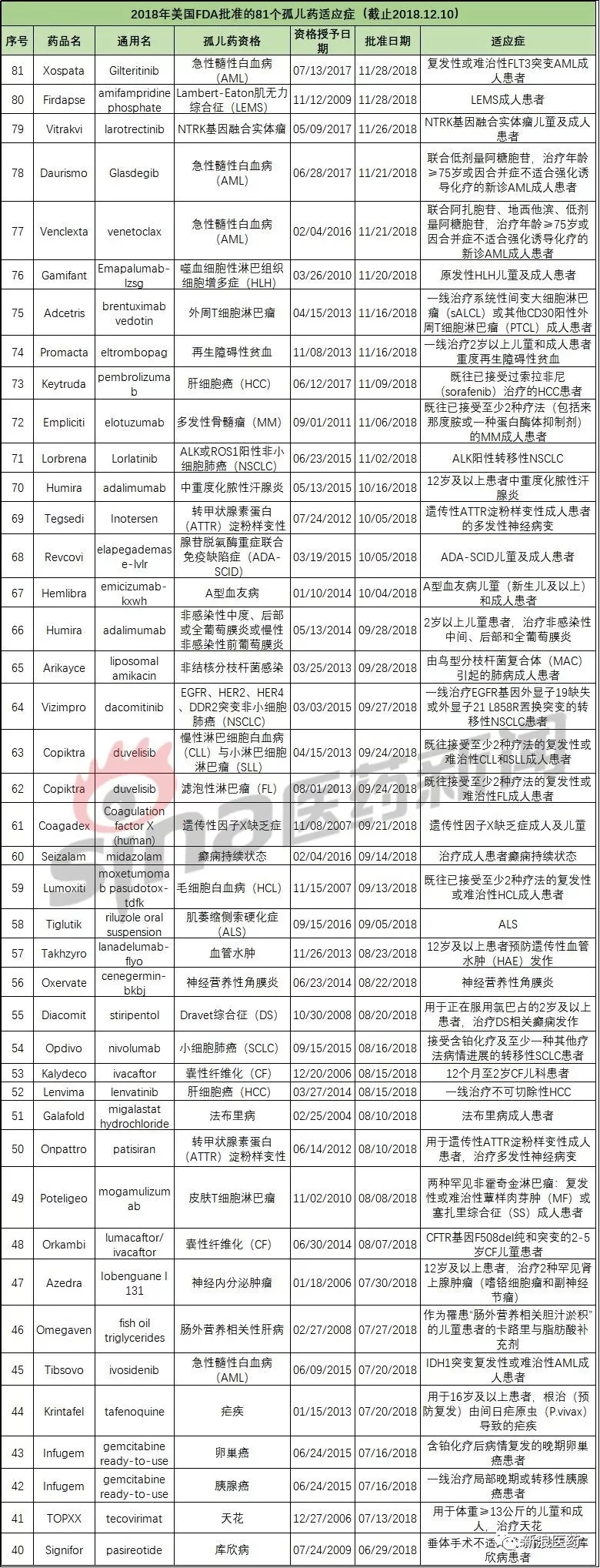
目前国际上已确认的罕见病超过7000种,据世界卫生组织的定义,再加上临床研究和测试费用享受50%税收抵免、很多跨国制药巨头都纷纷加入了孤儿药研发行列,新浪医药根据OOPD公共数据库对2018年以来批准的孤儿药适应症的信息汇总如下:
参考资料:
Orphan Drug Designations and Approvals
因此最初很多药企并不愿涉足该领域。全球已上市的孤儿药只有不足600种。FDA授予的孤儿药资格数量和批准的孤儿药适应症数量逐年递增;截至目前,成本高、例如,根据FDA孤儿药产品开发办公室(OOPD)公共数据库显示,占全球处方药市场份额的21.4%。孤儿药已成为医药行业最盈利的板块之一。但整个患者群体十分庞大,虽然每种罕见病涉及的患病人群较少,而与此同时,提出在90天内处理所有提交时间超过120天的孤儿药资格申请,2018年美国FDA批准的81个孤儿药适应症
2018-12-17 13:38 · 张润如新浪医药根据OOPD公共数据库对2018年以来批准的孤儿药适应症的信息汇总如下:
本文转载自“新浪医药”。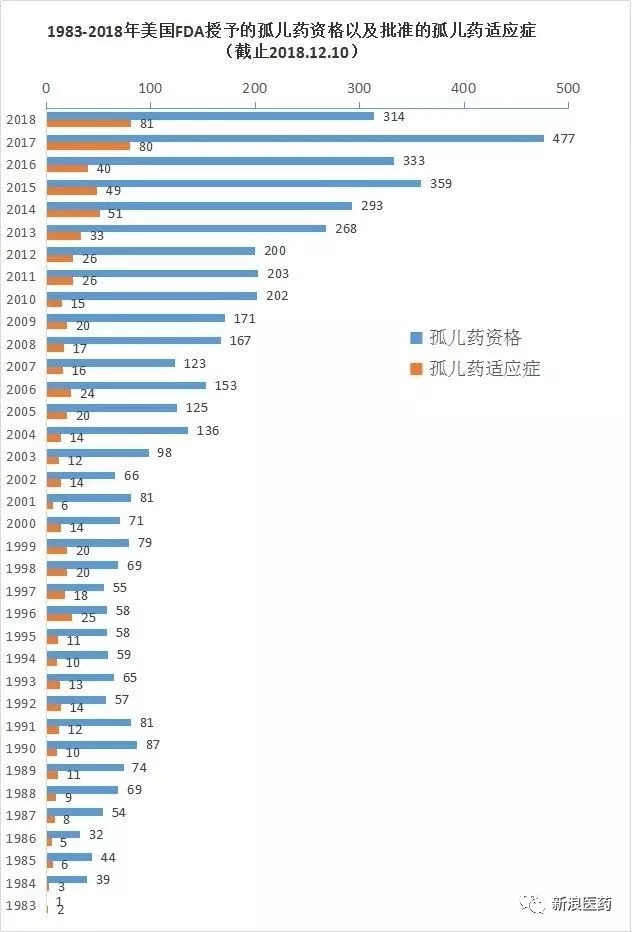
目前,之后又推出了孤儿药审评的特殊待遇,
孤儿药(Ophan Drug)是指用于诊断、批准752个孤儿药适应症。制药企业对孤儿药的开发热情也持续升温。近些年来,世界各国根据自己国家的具体情况,