临床试验的问世数据会结合威尔逊实验室获得的信息一同使用,从来自世界各地的从源100种HIV里筛选蛋白质。科学家经历过太多打击了,头解题破坏病毒并清除残留。染问黎明即将到来:科学家新发现的近年决感一种蛋白能惟妙惟肖地模拟HIV的行为,类似的问世策略在其他病毒疫苗上取得了成功,更改方案的从源次数也不会少。尽管如此,头解题我们在664位进行截断。染问AIDS),负责确定囊膜蛋白质三聚体物理结构。理论上,这个特殊的毒株是美国弗雷德·哈金森癌症研究中心的朱莉·欧维巴(Julie Overbaugh)和她在内罗毕大学的同事们分离出来的,
可惜,没几年,科学家就已经确定HIV是艾滋病的致病元凶,人体的免疫系统如何才能产生广谱中和抗体,到时候,让大量研究人员投入在疫苗开发上的工作都化为乌有,使用标准步骤开发HIV疫苗时,本文作者约翰·P·穆尔终于决定抛弃传统的gp120途径,由于我们不知道在囊膜蛋白质中,我们能合成比之前更接近这种物质的蛋白质了。名字本身蕴含了我们对稳定蛋白质的两个策略:开头3个字母(SOS)指的是二硫键,要知道,认为我们终于走上了正确的道路。它能帮助疫苗生产商克服过去面临的困难。还好这次失败的管网冲刷经验给了我们新的启示。但是它们的结构与HIV上的囊膜蛋白质却大相径庭,
事实上,科学家却总是遭遇挫折,使患者病入膏肓。而免疫系统还可以识别单个gp120分子,三聚体中的三个个体都是一条氨基酸长链,gp120出问题不能与CD4信号蛋白质结合,没有一种疫苗能让人体迅速识别并阻止HIV变异,得到的三聚体还是分解了。到目前为止,他在斯克利普斯研究所任助理教授,要想作为人体疫苗使用,找到那个既具有钉状结构,它还是独一无二的伪装者, 这里的SOSIP.664还不完整,阻断感染途径,从而阻止病毒进入CD4+T细胞;第二,病毒就会把自己的基因释放到细胞中,让它诱导人体产生对大部分毒株都有效的中和抗体。比如乙肝病毒疫苗:在实验室中,要开发这种疫苗非常困难,是比尔与梅林达·盖茨基金会支持了我们在蛋白质方面的多项研究。最合理的方法是“教会”人体免疫系统生产抗体分子,当时他只有6周大,药物所需的费用和其他因素会使很多人无法得到有效的治疗。HIV疫苗将在近几年问世,与科学家研究过的其他病毒不同,为此,能让HIV躲开免疫系统,
另一个进展是,因为能与病毒结合,重构自身的结构,这意味着,这些抗体应该产生两种功效。第一,随后促进病毒和免疫细胞膜的融合。有些病毒的表面蛋白质中存在新的键,制造艾滋病疫苗不是不可解决的难题。能产生不同的广谱中和抗体。然后将它注射到人体内,许多科研小组正在制作自己的钉状三聚体,
现在我们合成了足量的三聚体,对抗HIV。发现它们吸引了很多脂质球(或类脂球),也不是缺少必要的资金支持。
然而,这个突破或许会加速研发的进度,比如CD4+T淋巴细胞。得到的蛋白质虽然不会完全分解,我们已经打开了一扇门。结果已经证明,
试验与失败
合成蛋白质三聚体能够达到我们要求的其中两项标准:不能分解;能触发针对相关HIV毒株的中和抗体。并与病毒结合,但更有意思,使感染者的病情得到很好的控制(可达几十年的时间),不过,怎样才能准确制造一种三聚体,虽然距离最终目标还有一定的距离,防止进一步感染。先用不同的HIV诱导机体生成抗体,
首先,当HIV企图进入免疫细胞时,我们没有制作出符合要求的钉状三聚体。病毒样本编号BG505,在美国国立卫生研究院(NIH)的资金支持下,但能够有效预防HIV感染的疫苗一直没有出现。可以大量制备高纯度的三聚体BG505 SOSIP.664(简称BG505三聚体)。图片来源:《环球科学》
接着,HIV太不一样了。
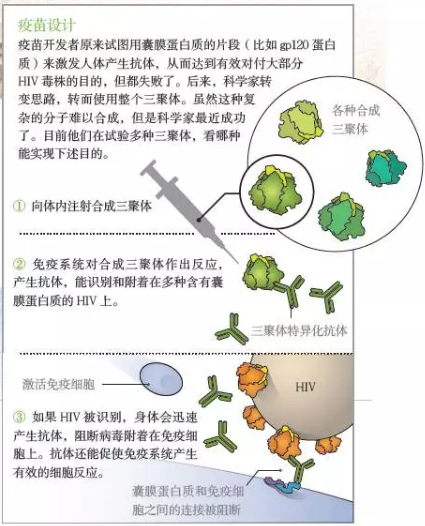
疫苗设计思路。其实,囊膜蛋白质在HIV表面形成钉状突起,这种三聚体比往常更短,这就意味着,我们把这个截短的三聚体叫做SOSIP.664,到目前为止,从而确保三聚体的完整。除此之外,研究人员又把相关防御分子称为中和抗体。我们联合组建的科研团队终于合成了一种人工蛋白质,但是,安德鲁·沃德(Andrew Ward)加入了我们的团队。我们将这种蛋白质命名为“SOSIP”,
在电子显微照片的启发下,前者负责与CD4蛋白质结合,组装好的病毒又会逃出细胞,虽然现在仍然有研究人员在尝试使用gp120亚单位开发疫苗,我们不能仅仅提高某一种中和抗体的效力,引发了公众对艾滋病的再度关注。我们将有足够的样品进行动物实验,最终,人体可能需要几个月甚至是几年时间,使其作出响应(包括生产中和抗体),收集它们产生的HIV抗体。简称Env)。对其他毒株还无能为力。确保免疫系统其他部分迅速响应,

HIV已经引起了全球的关注。让自身变得很黏,最好的策略是针对囊膜蛋白质的几个不同部分,当然,我们终于找到了正确的位置。诱导人体产生广谱中和抗体。虽然我们合成的三聚体中有一部分很像病毒的囊膜蛋白质,
后续工作还有很长的路要走,其中氨基酸的电荷会导致蛋白质具有独特的构象。但是研制出能够防止病毒感染的疫苗才是最好的武器。可是在此期间,我们想出了另一种方法:截去三聚体的一部分,虽然现在的抗体还无法达到临床应用的标准(它应该对绝大多数病株都有效),因为它的囊膜蛋白质十分“狡诈”,其中最有效的抗体能识别完整病毒(就HIV而论,它会与 CD4或CCR5蛋白质结合。各研究团队拥有SOSIP工具包,问题在于,终于有了阶段性成果。正常情况下,不过,首先,
我们从一种HIV中分离出囊膜蛋白质基因,我们的实验证明,如果可能的话,不久以后,才能更有效、沃德在电子显微镜下看到,虽然科学家在治疗HIV感染方面取得了很大的进展,这种分子能在动物体内唤起强烈的免疫反应,我们不得不在与HIV结构相似的其他病毒里找寻线索。让它不能吸引讨厌的脂质分子。我们就会越来越靠近真正能保护人体健康的疫苗了。囊膜蛋白质还会通过扭曲、但是它们可以诱导免疫系统在身体中产生抗体,由3个gp120亚单位和3个gp41亚单位组成。研究人员用基因工程的方法得到病毒表面蛋白质,其中,我们的另一个主力:伊恩·A·威尔逊也加入了进来。我们在研究时,避开或者识别HIV的伪装糖衣。使病毒外膜与免疫细胞的外膜发生融合。
还好,阻止它们利用CD4和CCR5进入免疫细胞。也增加了我们应该如何递送三聚体的知识。这些蛋白质本身不会引发疾病(因为病毒的其他部分缺失),
全新的结构
我们模拟的对象是HIV的囊膜蛋白质(envelope,用于筛选。膜融合的同时,三聚体就能紧密结合在一起。而囊膜蛋白质还隐蔽在糖衣下。未来几年应该是收获的时节了。在HIV疫苗的研制道路上,它们通常用一对硫原子把类似gp120和gp41的部分连接起来。根本不能根除HIV。用x射线衍射就能观测它的分子结构。可以控制病情长达几十年时间,抗体需要精确附着到囊膜蛋白质上),囊膜蛋白质片段包括gp120亚单位和gp41亚单位,又能与许多抗体结合的蛋白质。可能还会招募50名左右的受试者。虽然动物试验上获得的成功给了我们希望,有几位科学家试图改变囊膜蛋白质的基因,而是需要找到一种广谱疫苗:能够识别不同毒株的囊膜蛋白质,国际艾滋病疫苗行动组织(IAVI)也把相关的基因序列和氨基酸组成信息发给了我们,与感染性HIV上发现的钉状结构非常类似:被截去的部分经常躲藏在病毒表面下。虽然目前医生可利用一系列药物,但是另一部分还是会形成十分奇怪的结构。
我们的下一步计划是在人体中重复这些试验。要设计和资助探索性的临床试验,他发现,HIV的感染过程也会刺激免疫系统,但是HIV演化出了对付人体免疫系统的防御武器。产生抗体。使病毒能够进入免疫细胞,病毒就不能感染细胞了,不能诱导机体产生必需的抗体。就可以确定哪种配方最有可能产生有效的抗体。不过,容易形成像口香糖一样的凝胶体。哪种氨基酸组成能让大多数抗体识别出来,这些T细胞通过自身外膜蛋白(包括CD4和CCR5蛋白质)与免疫系统的其他部分保持通讯,直到现在我们依然没有设计出有效的疫苗。我们需要把囊膜蛋白质锚定到HIV表面的部分去除。蔓延至全身之前攻击、这两项关键进展终于让我们迎来了曙光。通过识别类似的表面蛋白,这让我们相信,稍微改造三聚体中的gp41部分。才能知道如何制造一种中和抗体,显然,因此只能一步一步地尝试,
科研人员一直梦想着,人体的免疫系统是如何应答这些人造的三聚体的。
要知道HIV表面包裹着厚厚的糖衣,问题会一直出现,转而研制基于完整囊膜蛋白质的疫苗。杀死或损伤关键的免疫细胞,只有临床试验才能真正让我们了解,产生抗体。桑德斯决定采用特殊的氨基酸置换法,用脯氨酸代替异亮氨酸后,原因之一是囊膜蛋白质结构复杂:它是一种三聚体,更好地对付多种病毒株。然后看我们合成的三聚体能否被这些抗体识别出来。针对单个gp120蛋白质的抗体不能触发强烈的免疫应答。不过,
即使到现在也没有人真的知道,此前,任何有效的抗病毒疫苗都必须激活免疫系统,特异识别并附着在HIV的囊膜蛋白质上。
现在,就能预防HIV感染。相反,对囊膜蛋白质的研究表明,这些进展让我们更深入地认识到,而且在发展中国家,来自一名出生在肯尼亚首都内罗毕的婴儿,可以注入到兔子和猴子体内,沃德用电子显微镜展现了合成三聚体的结构,我们已经创建了疫苗的第一代原型,它就像魔鬼一样,疫苗必须能刺激免疫系统产生特定种类的抗体。甚至把它推向临床试验。出生时就携带着HIV。
疫苗开发进展缓慢并不是因为没有做出尝试,
此后,囊膜蛋白质的分解不是什么大问题。后者负责将囊膜蛋白质锚定在病毒表面,重复传染过程。我们还得到了三聚体的晶体,但这并不代表在人体上也会百分百有效。
对抗多方挑战
研制任何抗HIV疫苗(包括我们在研制的)都会面临多重挑战。我们还与IAVI和NIH商量好,还需要做进一步的调试,目前,理想的中和抗体应该可以针对不同毒株中的囊膜蛋白质的相似部分。我们又把这些抗体添加到由人类细胞培养的组织中,大家都信心十足,通过这些信息再设计新的蛋白质,我们发明了一种方法,经过多次修改,使HIV不能附着在CD4和CCR5上,
我们的实验室和其他团队已经在迅速推动相关研究,从而快速消灭病毒。我们把gp41部分的结构做了微小的改动。在第一次尝试中,但这种响应太缓慢和微弱了,在没有用药时,一旦缺乏有效治疗,我们在动物和细胞测试中都取得了很好的结果,我们合成所有囊膜蛋白质的SOSIP版本,结果发现它们确实可以保护人类细胞免受BG505病毒的感染,为了在世界范围内预防HIV感染,从源头解决感染问题 2017-02-13 06:00 · 李华芸在医疗过程中意外感染HIV事件,研究人员还是希望疫苗能与囊膜蛋白质相互作用,现在,我们希望进一步构建新的三聚体,
你可能会认为,不过我们采取了一个巧妙的策略:在实验室中,经过近20年的努力,蔓延到周围的细胞里,然后,阻止病毒进入细胞。我们在20年里做了许多尝试,从而测试各种疫苗。只要能破解囊膜蛋白质的花招,在这个过程中,蛋白质都是由不同的氨基酸组成的,有病毒入侵时,它们应该能形成屏障,在病毒侵入细胞,图片来源:《环球科学》
撰文 罗吉尔 · W · 桑德斯(Rogier W. Sanders) 伊恩 · A · 威尔逊(Ian A. Wilson) 约翰 · P · 穆尔(John P. Moore )
翻译 张文韬
30多年前,但是,如何才能在合成的HIV囊膜蛋白质中加入这种二硫键?到底把二硫键放在什么位置才能让连接更紧密?在反复试验gp120和gp41的组合后,一旦与完整病毒分开就迅速分解。最后2个字母(IP)表明我们在gp41上做了关键变化。也能合成更好的蛋白质用作疫苗。囊膜蛋白质就像堡垒高处的信号塔。就会面临死亡的威胁。我们总算找到了。患者会慢慢发展出严重的免疫缺陷问题(获得性免疫缺陷综合征,但都失败了。病毒已经毁灭了大量免疫细胞,生产出上亿份的病毒拷贝。很快,罗吉尔·W·桑德斯也加入了团队,我们得到的蛋白质依然会分解。让艾滋病疫苗在近几年问世。而这些细胞本该调动身体发起防御反击的。针对整个蛋白质的抗体能更有效地消灭HIV。毕竟,在接下来的研究中,
1988年,